STAFF
Staff
【血液グループ】基礎研究
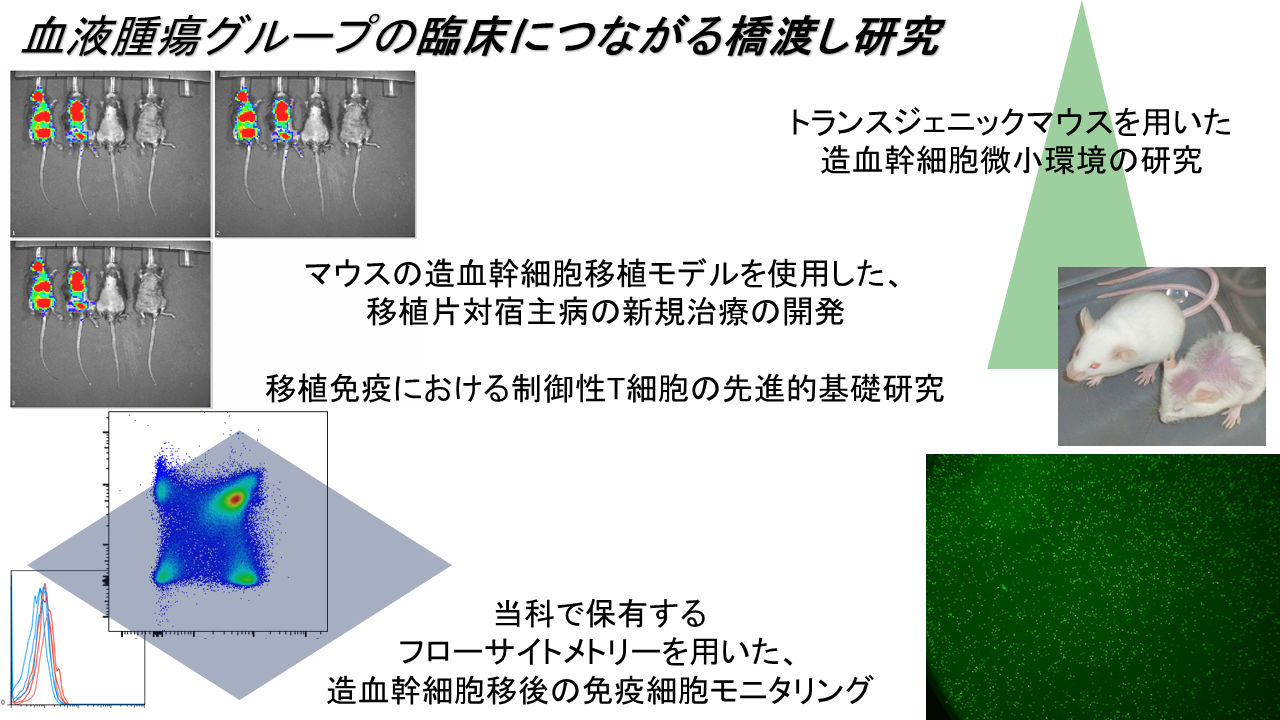
同種造血幹細胞移植は、移植片対白血病効果(GVL)により白血病に治癒をもたらす治療法として確立していますが、致死的合併症である移植片対宿主病(GVHD)は今日なお克服すべき課題です。
近年、移植前治療として行われる大量抗癌剤や放射線を減量することによって、従来では不可能であった高齢者への移植が可能となっています。加えて、HLA不一致移植の普及に伴い移植件数は年々増加しており、GVHD制御の重要性はさらに高まっています。
GVL効果を損なわずに、GVHDをはじめとした移植後合併症をコントロールすることは、移植成績の向上に直結する重要な課題であり、私たちは様々なアプローチにより移植後免疫のコントールを試みています。
| ― 研究グループ紹介 ― |
| ● 移植免疫研究 (PDFで開きます) |